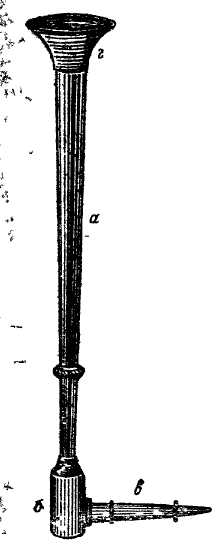
Рис.1 Классическая паяльная трубка
(Из книги П.П. Пилипенко, П.В. Калинин Определитель минералов при помощи паяльной трубки Госгеолиздат М.-Л. 1941 с моими добавлениями)
I. ЛАБОРАТОРНЫЕ ПРИНАДЛЕЖНОСТИ И РЕАКТИВЫ
Лабораторные принадлежности
Приборы, применяемые при определении минералов„ методом паяльной трубки;, отличаются большой простотой, портативностью и легкой доступностью. Все необходимые для работы приборы и реактивы могут быть помещены в небольшой ящик весом 1—2 кг.
1. Паяльная трубка. Наиболее распространенной и удобной является трубка, сконструированная Ганом (1745—1818.) Эта паяльная трубка (рис. 1) состоит из четырех частей: конической трубки а длиной 10 — 12 см, цилиндрического барабана б для конденсации влажных частиц воздуха при дутье, наконечника в, вставленного под прямым углом в барабан, и мундштука г, вставляемого в коническую трубку и служащего для удобства вдувания в нее воздуха. Наконечник в должен иметь узкое, почти волосное (0,4—0,6 мм) и совершенно правильное отверстие, через которое подается воздух к источнику горения.
Паяльную трубку можно заменить иголкой от медицинского шприца подходящего размера у которой аккуратно стачивают кончик до получения прямого среза. В качестве источника воздуха в этом случае хорошо подходит аквариумный компрессор.
|
Рис.1 Классическая паяльная трубка |
2. Источники горения. В условиях полевой работы наиболее доступным и удобным источником горения является обыкновенная стеариновая свеча. Можно также пользоваться спиртовой лампочкой (рис. 2). В качестве горючего применяется спирт с примесью скипидара или бензола в количестве 1/10~1/20 всей смеси. В лабораторных условиях, где имеется газ, удобно пользоваться небольшим коптящим пламенем бунзеновской горелки, но при этом следует иметь в виду, что при получении реакции на серную печень газовой горелкой пользоваться нельзя, так как газ во многих случаях содержит значительное количество серы.
Очень хорошо подходят для большинства целей появившиеся в продаже газовые микрогорелки для пайки электронных компонентов. Следует отметить, что применяемый в них газ для зажигалок также содержит существенные количества серы.
|
Рис.2. Спиртовка |
3. Пинцет самозажимающийся (рис. 3) употребляется . для внесения в пламя паяльной трубки осколочков минералов при испытании их на плавкость и магнитность, на окрашивание пламени и т. п. За отсутствием самозажимающихся пинцетов можно употреблять обычные медицинские, хотя они менее удобны для работы. Пинцет необходимо держать в чистоте.
|
Рис. 3. Пинцет самозажимающийся |
4. Платиновая проволока длиной до 5 см, сечением в 0,4 мм впаивается одним концом в стеклянную палочку или стеклянную трубку (рис. 4). Употребляется при исследовании на цветные перлы, окрашивание пламени и т. д. Для большинства реакций возможно применение проволоки из тантала или ниобия.
|
Рис. 4. Платиновая проволочка |
5. Молоточек и наковальня, необходимые для отбивания кусочков минерала, для размельчения материала, для, изучения ковкости и хрупкости металлических корольков. Наиболее удобным следует считать молоток Платнера (рис. 5), который при длине металлической части в 6,5см на одном конце снабжен четырехугольной пяткой в 1 см", а на другом — плоским долотцем. Ручка имеет около 20 см длины. Очень хорошо в острый боек впаять пластинку из твердого сплава ВК15.
|
Рис. 5. Молоток Платнера |
Наковальня изготовляется из инструментальной стали и представляет собой закаленную плитку толщиной в 1 см со сторонами в 4 см.
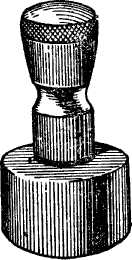
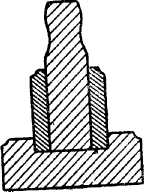
6. Ступки: а) стальные, системы Абиха (рис. 6 и 7), употребляются для раздробления больших кусков минерала, б) агатовые (рис. 8) — для истирания минералов в порошок, в) фарфоровые — для истирания мягких минералов и сухих реактивов.
 |
 |
|
| Ступка Абиха | Рис 8. Агатовая ступка |
|
| Рис 6. Внешний вид | Рис 7. Разрез | |
7. Магнитная стрелка для определения минералов на магнитность; она может быть заменена стальным намагниченным перочинным ножом. Очень удобно применять намагниченную иглу на нитке, подвешенную на штативе. С ее помощью можно проверить магнитность очень мелких образцов.
8. Лупа с короткофокусным расстоянием, с увеличением в 5—10 раз.
9. Фарфоровая неглазурованная пластинка (бисквит) размером 6X9 см, необходимая для получения цветной черты минералов.
10. Уголь древесный, лучше всего березовый или липовый, в пластинках размером 10x4x3 см. Выбирают всегда гладкие куски без трещин и сучков, так как сучковатые растрескиваются и выбрасывают испытуемое вещество. Можно искусственно приготовить пластинки из прессованного угольного порошка и клея.
11. Гипсовые пластинки размером 4x8 см. Их можно изготовить самому из аптекарского обожженного гипса. Гипсовой кашицей смазывают стекло; после затвердевания гипс режут на пластинки нужного размера
|
|
| Рис. 9. Стеклянные трубки а—открытая (уменьш.), б—закрытая | Рис. 10. Склянка для реактивов |
12. Алюминиевые пластинки для реакции на вольфрам. Наиболее чистый алюминий применяется для фиксации крышек пузырьков с лекарствами для инъекций.
13. Стеклянные трубки из тугоплавкого стекла: а) открытые, длиной 15 см (рис. 9а) и б) закрытые, запаянные с одного конца (рис. 9б), длиной около 8 см. Внутренний диаметр трубок 3-4 мм.
14. Пробирки, воронки небольшого размера.
15. Фарфоровые чашечки, небольшие часовые стекла.
16. Роговая или костяная ложечка для сухих реактивов.
17. Склянки и капельницы для жидких реактивов (рис. 10).
18. Синие и зеленые стекла (светофильтры) для наблюдения за окрашиванием пламени.
19. Шкала твердости по Моосу.
20. Фильтровальная бумага.
Необходимые реактивы
А. Сухие реактивы
Б. Жидкие реактивы
II. МЕТОД РАБОТЫ И ОСНОВНЫЕ ХИМИЧЕСКИЕ РЕАКЦИИ
Метод определения минералов с помощью паяльной трубки основан на использовании пламени какого-нибудь источника горения: газовой горелки, спиртовой лампы или свечи. Во всех случаях пламя играет роль не только как физический фактор, определяющий высокую температуру, необходимую для производства многих реакций, но является вместе с тем и химическим фактором, входящим в процесс при производстве анализа минералов. Большинство реакций основано на применении окислительного или восстановительного пламени, получаемых при помощи паяльной трубки.
Строение пламени
Газовая горелка Бунзена может вполне заменить паяльную трубку, так как строение пламени горелки аналогично строению пламени, получаемого с помощью паяльной трубки.
Горючий газ, состоит большей частью из горючих углеводородов СnН2n+2 (метан, пропан, бутан и т. д.). При нагревании углеводороды распадаются на метан и углерод который, раскаляясь обеспечивает свечение пламени. При вдувании в пламя горючего газа достаточного количества воздуха углерод сгорает нацело, и пламя становится бесцветным. Приток воздуха в газовых горелках регулируется различными приспособлениями.
|
|
| Рис 11. Cxeма строения пламени бунзеновской горелки | Рис. 12. Схема строения пламени свечи |
В пламени газовой горелки Бунзен различает
следующие части (рис. 11):
1) внутренний конус а синего цвета с
низкой температурой, где происходит лишь
разложение горючего газа на составные части; эта
часть пламени состоит почти из равных количеств
несгоревшего газа и воздуха;
2) средний восстановительный конус б,
состоящий из смеси воздуха и горящего газа,
богатого СО,
3) внешний окислительный конус с,
богатый кислородом.
В пламени свечи можно различать также три
конуса (рис. 12):
1) внутренний конус а темного цвета с
низкой температурой; он состоит из углеводородов
— продуктов разложения свечи;
2) средний конус б — светящаяся часть
пламени. Здесь под влиянием более высокой
температуры и кислорода атмосферы поднимающиеся
кверху от фитиля углеводороды разлагаются на
составные части — углерод и водород, которые,
соединяясь с кислородом, дают окись углерода СО и
Н2О; часть углерода остается свободной,
мельчайшие частицы его раскаляются и придают
пламени свечи яркую желтую окраску. Если в эту
часть пламени ввести какой-либо холодный
предмет, он покроется копотью; эта часть пламени
богата СО, С и Н; окись углерода является сильным
восстановителем, поэтому эта часть пламени
называется восстановительной;
3) наружный конус с образует невидимую
оболочку, окружающую пламя свечи; здесь, под
влиянием значительного притока кислорода
воздуха, из углерода получается СО2, из
водорода Н2О, и остается некоторое
количество свободного кислорода; при высокой
температуре избыточный кислород обладает
чрезвычайно большой окислительной способностью,
поэтому эта часть пламени называется
окислительной; таким образом, строение пламени
свечи схоже со строением пламени бунзеновской
горелки, разница заключается лишь в размере
отдельных частей и наличии в конусе б
пламени свечи большого количества несгоревших
частиц углерода.
|
Рис. 13. Схема строения пламени паяльной трубки |
При определении минералов обычным пламенем свечи пользоваться трудно вследствие выделяющейся копоти и сравнительно низкой температуры. Эти недостатки устраняются с помощью паяльной трубки.
Если вдувать через паяльную трубку воздух в пламя какого-либо источника горения, то получим в миниатюре то же строение пламени, как в бунзеновской горелке (рис. 13). При ровном непрерывном дутье получается полное сгорание углерода, пламя приобретает форму тонко заостренного конуса, в котором можно различать три части:
Успех в работе при определении минералов заключается в умении правильно пользоваться паяльной трубкой, поэтому непременным условием для работающего является освоение техники дутья, т. е. правильного получения и использования того или иного вида пламени.
Воздух вдувают спокойно, без напряжения легких, с помощью мускулов щек. Запас воздуха пополняется дыханием через нос. Получение ровного пламени с отчетливыми конусами и; продолжительное дутье является непременным условием успеха и скорости реакций плавления, окисления и восстановления.
|
|
Рис 14. Схема строения пламени паяльной трубки (для реакции окисления |
Рис. 15 Схема строения пламени паяльной трубки (для реакции восстановления) |
Практически окислительное пламя легче всего получить, если поместить конец паяльной трубки внутрь пламени и дуть сильно (рис. 14). Для получения восстановительного пламени кончик паяльной трубки помещают перед пламенем, не вводя внутрь его, и дуют не особенно, сильно; в этом случае язычок восстановительного конуса получается больше (рис. 15).
Получение цветных перлов.
Начинающему, чтобы научиться управлять пламенем паяльной трубки и быть уверенным в правильности наблюдений, лучше, всего проделать опыты с окрашиванием и обесцвечиванием стекол буры и фосфорной соли с солями марганца и меди. Эти реакции основаны на различной степени окисления Mn и Cu, которые и придают плавням ту или иную характерную окраску,
Реакции с бурой:
Na2B4O7 + MnO = 2NaBO2 + Mn(BO2)2; Na2B4O7 + CuO = 2NaBO2 + Cu(BO2)2
Реакции с фосфорной солью:
NaPO3 + MnO = MnNaPO4; NaPO3 + CuO = CuNaPO4
Однако в этих реакциях бура и фосфорная соль скорее играют роль растворителей, в которых соли Mn и Cu под действием окислительного или восстановительного пламени принимают различные степени окисления:
2MnO2 + 3O = Мп2О7
(черного цвета) + (окислительное пламя) = (перл красно-фиолетового цвета)
Мп2О7 + 5СO = 2MnО + 5СО2
(восстановительное пламя) (перл бесцветный)
Практические приемы получения цветных перлов сводятся к: следующему. Берут платиновую проволоку, конец которой впаян в стеклянную палочку или зажат в специальный держатель (рис. 4). Свободный конец проволоки сгибают в небольшое ушко-петельку (лучше всего сгибать вокруг заточенного карандаша или кончика паяльной трубки); перед употреблением проволоку тщательно очищают путем длительного прокаливания в окислительном пламени.
Буру или фосфорную соль отсыпают в небольшом количестве в фарфоровую чашечку или на бумагу. Ушко платиновой проволоки раскаляют докрасна и погружают в приготовленную отсыпанную соль, которая очень легко прилипает к раскаленной проволочке в достаточном количестве. Затем ушко с приставшей солью снова вносят в пламя паяльной трубки. При этом не обезвоженная бура и фосфорная соль начинают вскипать и вспучиваться, теряя воду, а потом спокойно сплавляются в прозрачное стекло. Полученный сплав охлаждают, а затем вводят в испытуемое вещество, следя за тем, чтобы к сплаву пристало всего лишь несколько крупинок вещества; затем вновь подвергают нагреванию в той или иной части пламени до тех пор, пока не прекратятся признаки химического взаимодействия, проявляющегося в виде выделения пузырьков газа, вихрей, струй и потоков. Когда все эти явления прекратятся, наблюдают полученное стекло как в горячем, так и в холодном состоянии
Ряд элементов дает чрезвычайно характерные цветные стекла (перлы), и их можно легко определить по табл. 1.
Чтобы освободить проволоку от полученного цветного перла или очистить ее от загрязнения, сплав раскаляют докрасна и быстрым, коротким движением стряхивают раскаленный шарик на железный поднос или в большую фарфоровую чашку. К оставшейся в ушке части снова набирают буры и повторяют операцию до тех пор, пока проволока не станет совершенно чистой, а перл — бесцветным и прозрачным. Не рекомендуется выдергивать сплав из проволочки или разбивать молоточком; в этом случае платиновая проволока легко портится. При работе с неизвестными сернистыми или мышьяковистыми веществами их следует предварительно обжигать на угле и лишь после этого брать насадку. Это делается в целях предохранения от порчи платиновой проволоки, дающей с некоторыми металлами легкоплавкие сплавы. Кроме того, это необходимо для получения кислородных соединений—окисей металлов, так как только окислившиеся соединения обладают способностью растворяться в плавнях с образованием цветных перлов. Необходимо также иметь в виду, что не следует нагревать платиновую проволоку в коптящем пламени| во избежание образования хрупкой углеродистой платины).
Таблица 1. Реакции с окрашиванием перлов буры и фосфорной солиЭлементы и комбинации |
Присадка |
Реакции с бурой | Реакции с фосфорной солью | ||||||
| окислительное пламя | восстановительное пламя | окислительное пламя | восстановительное пламя | ||||||
| горячее стекло | холодное стекло | горячее стекло | холодное стекло | горячее стекло | холодное стекло | горячее стекло | холодное стекло | ||
Со |
От мал. до средн. |
Синее |
Синее | Синее | Синее | Синее | Синее | Синее | Синее |
Сг |
От мал. до средн. |
Желтое |
Желто-зеленое | Зеленое | Зеленое | Желтое | Желто-зеленое | Зеленое | Зеленое |
Mn |
Мал. |
Фиолетовое |
Красно-фиолетовое | Бесцветное | Бесцветное | Серо-фиолетовое | Фиолетовое | Бесцветное | Бесцветное |
Cu |
От мал. до средн. |
Зеленое |
Голубое | Бледно-зеленое | Красное | Зеленое | Голубое | Бледно-зеленое | Бесцветное |
Fe |
От мал. до средн. |
Желтое |
Бесцветное | Бутылочно-зеленое | Бледно-зеленое | Буро-красное | Желтое | Желто-красное | Бесцветное |
Ni |
От мал. до средн. |
Фиолетовое |
Красно-бурое | Серое непрозрачное | Серое непрозрачное | Буро-красное | Желто-красное | Красное | Желто-красное |
V |
Мал. |
Желтое |
Бледножел-то-зеленое | Грязно-зеленое | Чисто-зеленое | Желтое | Желтое | Грязно-зеленое | Чисто-зеленое |
Mo |
Больш. |
Бледно- желтое |
Бесцветное | Бурое | Бурое | Желто-зеленое | Бесцветное | Грязно-зеленое | Чисто-зеленое |
Ti |
Средн. |
Бледно-желтое |
Бесцветное | Сероватое | Буро-фиолетовое | Бледножелтое | Бесцветное | Сероватое | Буро-фиолетовое |
Nb |
От мал. до больш. |
Бесцветное |
Непрозрачное белое | Бледно-желтое | Бесцветное | Бледножелтое | Бесцветное | Бурое | Бурое |
Се |
Больш. |
Красно-бурое |
Желтое | Бесцветное | Белое | Красно-бурое | Желтое | Бесцветное | Бесцветное |
U |
От мал. до средн. | Желтое |
Бесцветное до желтого | Бледно-зеленое | Бесцветное до бледнозеленого | Желтое | Желтое до желто-зеленого | Зеленое | Зеленое |
W |
Больш. |
Бледно-желтое |
Бесцветное | Желтое | Желтое и желто-бурое | Бледно-желтое | Бесцветное | Грязно-голубое | Чисто-голубое |
Fe + V |
От средн. до больш. |
Оранжевое |
Зелено-желтое | Грязно-зеленое | Зеленое | Бурое | Светло-бурое | Грязно-фиолетовое | Фиолетовое |
Fe + W |
Средн. |
Желтое |
Бледно-желтое | Желто-зеленое | Бледно-зеленое | Бурое | Желтое | Фиолетовое | Красное |
Fe + Mn |
От мал. до сред. |
Красно-фиолетовое |
Буро-фиолетовое | Грязно-зеленое | Зеленое | Вишневое | Вишневое | Зеленое | Фиолетовое |
Fe + Cu |
Средн. |
Зеленое |
Зеленое | Зеленое | Красное | Желто-зеленое | Зеленое | Зеленое | Голубое |
Fe+Co |
Средн. |
Зеленое |
Синее | Зелено-синее | Синее | Зеленое | Синее | Зеленое | Синее |
Fe + Ni |
Средн. |
Фиолетовое |
Бурое | Зеленое | Серо-зеленое | Красно-бурое | Бурое | Красно-бурое | Бурое |
Fe + Cr |
Средн. |
Желтое |
Желто-зеленое | Грязно-зеленое | Зеленое | Желтое | Желто-зеленое | Грязно-зеленое | Зеленое |
Fe + Ti |
Средн. |
Желтое |
Бесцветное | Зеленое | Кроваво-красное | Желтое | Бесцветное | Фиолетово-бурое | Кроваво-красное |
Fe+Co+Mn |
Средн. |
Красно-фиолетовое |
Красно-фиолетовое | Зеленое | Синее | Вишневое | Фиолетовое | Фиолетовое | Синее |
Mn + Cu |
Средн. |
Фиолетовое |
Бурое | Бесцветное | Бесцветное | Фиолетовое | Бурое | Бесцветное | Бесцветное |
Mn + Cr |
Средн. |
Фиолетовое |
Грязно-зеленое | Зеленое | Зеленое | Грязно-фиолетовое | Бурое | Желто-зеленое | Зеленое |
Ni + Co |
Средн. |
фиолетовое |
Фиолетовое | Серо-синее до непрозрачного | Серо-синее до непрозрачного | Фиолетовое | Грязно-зеленое | Фиолетовое | Синее |
Испытания на угле
Некоторые химические элементы дают характерные реакции на угольной пластинке. Пользуясь окислительным пламенем, получают белые или цветные налеты окисей металлов, появление которых сопровождается иногда характерным запахом, дымом, свечением, окрашиванием пламени и т. д. При смачивании раствором азотнокислого кобальта некоторые налеты дают характерное окрашивание.
При действии восстановительного пламени можно получить, например из сернистых соединений, небольшие шарики восстановленного металла (так называемые „корольки"). Получение корольков на угле происходит или только с помощью восстановительного пламени или при смешении испытуемого вещества с содой.
Кроме того, на угле производятся и другие реакции, как-то: получение сплава для реакции на серную печень, окрашивание пламени галоидными соединениями меди и др.
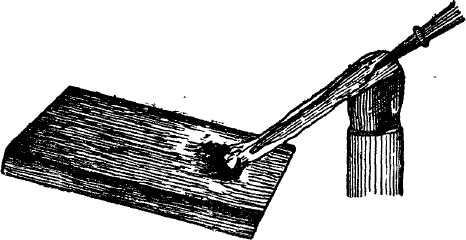
Рис. 16. Получение корольков металла на угле
Практические приемы работы с угольной пластинкой сводятся к следующему: берут более или менее гладкую пластинку древесного угля и делают в ней с одного края с помощью небольшого сверла или ножом углубление — лунку (рис. 16); поместив в лунку тонко измельченное исследуемое вещество или его смесь с тройным объемом соды, подвергают его воздействию окислительного или восстановительного пламени. Чтобы вещества не выдувалось из лунки, перед нагреванием его следует прижать пальцем или даже можно смочить двумя-тремя каплями воды. Чтобы уголь не прогорел, следует нагревать только пробу.
Налеты на угле.
Для лучшего получения налетов угольную пластинку следует держать косо, под углом 30—40°, так, чтобы выделяющиеся окислы металлов отлагались на угле, а не улетали мимо него.
Характерные налеты, получающиеся на угольной пластинке, приводятся в табл. 2.
Таблица 2. Налеты на угле
| Вещество | Характер и окраска налета, |
| As | Белый дым с характерным чесночным запахом. Налет на угле в виде As2O3, обычно далеко от пробы, серого цвета |
| Sb | Густой белый налет (Sb2O3), близко от пробы; в тонком слое—с голубеватым оттенком |
| Zn | Близко от пробы слабый налет, в горячем состоянии желтого цвета, в холодном—белого. Смоченный раствором Co(NO3)2 и прокаленный вновь в окислительном пламени налет приобретает зеленый цвет (Zn,Co)O. Ринманова зелень |
| Mo | Налет близко от пробы, в горячем состоянии бледно-желтый и в холодном — белый. При действии восстановительного пламени (очень коротком, следует только прикоснуться) налет приобретает бархатно-синий цвет, при более длительном— медно-красный |
| Sn | В горячем состоянии бледно-жёлтый налет, в холодном — белый, недалеко от пробы. Смоченный раствором Co(NO3)2 и прокаленный вновь в окислительном пламени, приобретает голубовато-зеленую окраску |
| Pb | Желтый налет, близко от пробы. При добавлении к пробе смеси (KJ+S) получается яркий желто-зеленый налет (FbJ2) с красной каймой, близ пробы |
| Bi | Легколетучий оранжево-желтый налет. При сплавлении вместе со смесью (KJ+ S) образуется желтый налет с ярко-красной каймой BiJ3 |
| Те | Белый близ пробы, серый с коричневым оттенком вдали от пробы, летучий; окрашивает восстановительное пламя в бледнозеленый цвет |
| Se | Близ пробы серый и белый (SeO) с красноватым оттенком (Se). Весьма летуч, окрашивает восстановительное пламя в голубой цвет. Характерный запах гнилой редьки |
| Tl | На алюминиевой пластинке или слюде черный налет. Очень летуч. Восстановительное пламя окрашивает в яркозеленый цвет |
Чрезвычайно характерные йодистые налеты можно получить также на гипсовой пластинке (табл. 3).
Таблица 3. Налеты на гипсовой пластинке
| Вещество | Характер и окраска налета |
| PbJ2 | Хромово-желтый летучий |
| ASJ3 | От желтого до оранжевого, .очень летучий, исчезает в парах NH3. Капля (NH4)2Sx дает на налете желтое кольцо, кото- : рое растворяется в капле NH4OH |
| SeJ3 | щ От оранжевого до красного, исчезает в большом количестве паров NH3. Капля (NH4)2Sx дает на налете оранжево-красное кольцо, которое не растворяется в капле NH4OH |
| HgJ | От багряного до желтого; в тонком слое при сильном нагревании тускложелтый или черный; в парах NHS ненадолго исчезает |
| SnJ4 | Коричневато-оранжевый |
| SeJ4 | Красновато-коричневый, почти багряный |
| BiJ31 | От шоколадно-коричневатого до багряного; в парах NH3 становится оранжевым, а потом вишнево-красным |
| TeJ4 | Пурпурно-коричневатый, с темными краями, исчезает в парах NH3 |
| MoJ4 | Ультрамариново-голубой |
1 Bi2O3 + 8HJ = ЗН2О + 2(BiJ4)H; BiJ4H + NH3 = Bi J4NH4.
Цветные реакции с азотнокислым кобальтом
При пробе с азотнокислым кобальтом исследуемое вещество необходимо прокалить в окислительном пламени. Прокаливание можно производить или в пинцете или на угле. Прокаленное вещество или налет, получаемый от него, смачиваются одной двумя каплями раствора Co(NO3)2 и снова подвергаются воздействию окислительного пламени. При этом получаются следующие цвета:
Zn дает травяно-зеленую окраску—зелень Ринмана (Zn,Co)C
Sn — голубовато-зеленую;
А1 — синюю — Тенарова синь (СоО • А12О3);
Mg — мясо-красную.
Цветные реакции с Co(NO3)2 могут маскироваться наличием железа в минералах, избытком Co-раствора или действием восстановительного пламени. Работающим необходимо всегда это иметь в виду. Кроме того, эти реакции возможны только с неплавкими веществами.
Получение корольков металлов на угле в восстановительном пламени
При получении корольков порошок испытуемого вещества смешивается с содой. При этом происходит следующее:
MeS + Na2CO3 —> Na2S + MeCO3.
При дальнейшем нагревании углекислые соединения распадаются: МеСО3 —> МеО + CO2.
При действии восстановительного пламени окислы восстанавливаются до свободного металла:
МеО + СО — Me + СО2.
Корольки испытываются на ковкость, хрупкость, магнитность, растворимость в кислотах и т. д. При испытании на растворимость в кислотах металлический королек лучше всего поместить на часовое стекло, прибавить 1 —2 капли азотной кислоты, слегка подогреть и затем прибавить несколько капель воды.
Среди корольков различают:
Pb — легко ковкий, растворяется в HNO3; от прибавления к раствору H2SO4 выпадает белый мелкокристаллический осадок;
Ag — менее ковкий, .чем Pb, растворяется в HNO3; раствор с каплей НС1 дает белый творожистый осадок, растворяющийся в аммиаке;
Sn — под действием HNO3 превращается в белую нерастворимую окись;
Pt — в кислотах не растворяется; растворяется лишь в царской водке;
Cu — (королек красного цвета) растворяется HNO3; при прибавлении избытка аммиака дает синее окрашивание;
Au — (желтого цвета) в HNO3 не растворяется;
Sb и Bi — серебряно-белые, хрупкие, кристаллические в изломе.
Определение серы в виде серной печени
Исследуемое вещество истирается в порошок и тщательно смешивается с двойным объемом соды (при исследовании сульфатов прибавляют немного измельченного угля), после чего смесь сплавляют. При этом получается: *
MeS + Na2CO3 == MeCO3 + Na2S.
Полученный сплав переносят на серебряную пластинку или монету и смачивают каплей воды. При наличии серы в соединении на пластинке появляется темно-бурое пятно от образования Ag2S:
Na2S+2Ag+2H2O + О = Ag2S + 2NaOH
Для этого опыта нельзя пользоваться пламенем горючего газа, так как в нем содержатся небольшие количества серы. Перед опытом серебряную монету необходимо очистить мелом чтобы удалить слой жира, могущий воспрепятствовать реакции.
Испытания в закрытой трубке
Эти испытания производятся с целью изучения реакций тог или иного вещества при весьма ограниченном доступе воздухе. Эти реакции во многом сходны с реакциями восстановления на угле и применяются для легко возгоняющихся элементов. Дл этой цели берется стеклянная трубка длиной 7—8 см, диаметром 5 мм; один конец такой трубки запаивается. В запаянный коне трубки кладут тонкие осколки или мелкие зерна вещества (тонкий порошок может прилипать к стенкам трубки и мешать наблюдению над возгонами); в некоторых случаях для ускорения реакции кладут небольшой кусочек угля. Верхний конец трубки держат между пальцами правой руки, направляя устье ее вверх и в сторону от лица, а нижний (с пробой) нагревают. Нагревание начинают медленно и осторожно, чтобы не произошло растрескивания стекла, затем конец с пробой вводят в самую горячую часть пламени паяльной трубки, чтобы вся проба была разогрет и реакция могла пройти до конца. При нагревании в закрытой трубке можно наблюдать следующие явления: плавление, растрескивание, свечение, изменение окраски, образование возгонов и налетов, выделения газообразных продуктов разложения вещества и т. д.
Некоторые испытания в закрытых трубках производятся с смесями тех или иных реактивов, например, с Na2CO3, с KHSO, с металлическим магнием и т. д.
Наиболее характерные реакции в закрытой трубке следующие:
Определение воды. Минералы, содержащие кристаллизационную, цеолитную или гидроксильную воду, при нагревании осколков в закрытой трубке выделяют на холодных стенка: верхней части трубки мельчайшие капли. По количеству выделившейся воды можно судить о том, много воды ил мало.
Определение S. Сернистые соединения дают налет красного цвета в горячем состоянии и желтого — в холодном.
Возгон мышьяка. При нагревании мышьяковистых соединений на холодных стенках трубки образуется возгон металлического мышьяка. При этом легко различаются два кольца—одно состоящее из черной аморфной массы, мышьяковое зеркало, другое, ближе ко дну трубки, серебристо-белое, сложенное кристаллическим веществом.
Испытания в открытой трубке
Эти испытания сходны с реакциями на угле в окислительном пламени. Здесь реакции идут в потоке воздуха, который поступает через короткое колено трубки, проходит над нагреваемой пробой, помещаемой в изгибе, и далее идет вверх, как по вытяжке, по длинному колену, что весьма способствует окислению взятого вещества. При опытах в открытой трубке применяют тонко истертый порошок, помещаемый в изогнутую часть через короткое колено. Трубку держат пинцетом довольно круто и прогревают вначале длинную часть, лежащую над пробой, потом нагревают пробу и затем короткий конец трубки; при этом внутри трубки устанавливается постоянная струя воздуха, необходимая для реакции. При опытах в открытой трубке можно получить следующие характерные налеты.
Мышьяк дает на далеком расстоянии от пробы белый налет As2O3, состоящий из мелких октаэдров. Чувствуется запах чеснока.
Сурьмянистые соединения дают плотный, белый нелетучий возгон близко от пробы.
Ртуть дает мелкие серые шарики. Ртуть хорошо и быстро получается при прибавлении железных опилок:
HgS+Fe = FeS+Hg.
Сера образует сернистый газ SO2, что легко узнать по характерному запаху. Смоченная синяя лакмусовая бумажка, вставленная в трубку, быстро окрашивается в красный цвет.
Определение плавкости минералов
Для определения плавкости минералов следует пользоваться наиболее высокой температурой, какую только можно получить с помощью паяльной трубки. Точка наиболее высокой температуры находится впереди восстановительного конуса. Исследуемый минерал стараются взять в виде возможно тонкого осколка (величиной 3—4 мм), зажимают его в пинцет так, чтобы острый конец выступал из кончиков пинцета, и подвергают воздействию максимальной температуры. Если минерал легкоплавкий, он быстро сплавляется в шарик, более трудноплавкие лишь слегка округляются на краях, а неплавкие даже после длительного нагревания остаются без изменения.
Степень плавкости определяется прилагаемой шкалой плавкости.
Шкала плавкости
1
• Антимонит (Sb2S3). Легко плавится даже в крупных осколках в обычном пламени свечи.При испытании на плавкость осколок минерала при нагревании иногда растрескивается, и частицы его разлетаются в разны стороны. Это происходит или от неравномерного нагревания минерала или от расширения включений в нем воды или углекислоты. В этом случае следует нагреть несколько кусочков в закрыто трубке и, когда растрескивание прекратится, выбрать подходящий осколок для дальнейшего испытания.
Иногда при нагревании осколки минералов начинают вздуваться, пузыриться или расщепляться на листочки и т. д. Все эти явления должны быть отмечены, так как они указывают на наличие в таких минералах воды или, иногда, СО2 и могут быт хорошим диагностическим признаком при отнесении минерала той или иной группе.
Оставшийся после прокаливания кусочек минерала не следует бросать: с ним необходимо проделать реакции на щелочность, окрашивание пламени, а также исследовать его на магнитность.
Определение щелочности
Для определения некоторых групп минералов, как-то: карбонатов, сульфатов и других, содержащих щелочные и щелочноземельные металлы, большое значение имеет реакция на щелочность. Щелочность минералов определяется с помощью реактивной куркумовой или лакмусовой бумажки. Для производства этой реакции берут небольшой осколочек минерала (можно взять для этой цели кусочек после испытания на плавкость), сильно прокаливают его в окислительном пламени и после охлаждения кладут на смоченную водой куркумовую или лакмусовую бумажку. Если через некоторое время желтая куркумовая бумажка дает красновато-бурое пятно, а красная лакмусовая —синее, то это указывает на положительную реакцию.
В основном, реакции сводятся к следующему:
СаСО3 при прокаливании CaO+CO2;
СаО+Н2О = Са(ОН)2 (действует как щелочь).
Окрашивание пламени
Минералы без металлического блеска следует испытать на реакцию окрашивания пламени. Эта реакция весьма характерна для минералов, содержащих щелочные и щелочно-земельные элементы. Сущность реакции заключается в том, что под влиянием высокой температуры пламени газовой горелки или пламени паяльной трубки более или менее летучие соединения щелочных и щелочноземельных металлов разлагаются, раскаленные пары металла ионизируются и производят окрашивание. Труднолетучие соединения следует предварительно перевести в более легколетучие, что достигается смачиванием предварительно прокаленного осколка минерала соляной кислотой.
Окрашивание пламени обычно наблюдают одновременно с определением плавкости минерала, или же для этого используют порошок минерала, который смачивают соляной кислотой и пробуют на платиновой проволочке. Конечно, перед испытанием платиновую проволоку необходимо очистить, промыть в кислоте и прокалить до полного удаления следов окрашивания пламени. Наиболее характерные реакции с окрашиванием пламени приведены в таблице 4.
Окрашивание пламени |
|||
| Цвет | Оттенок | Элемент | Примечания |
| Желтый | Сильный | Na | Только сильное и длительное окрашиванне доказывает присутствие Na. Через синее стекло пламени не видно |
| Красный | От желтоватого до оранжевого | Са | При смачивании НСl пламя получает значительно более интенсивную окраску. Через зеленое стекло оно кажется зеленым |
| Красный | Багряный | Sr | Наблюдается щелочная реакция после прокаливания (то же и у Са, но не у Li). Пламя при рассматривании через зелено стекло кажется светложелтым |
| Красный | Багряный | Li | Щелочной реакции после прокаливания уже не наблюдается (отличие от Sr) Через зеленое стекло пламени не видно. |
| Зеленый | Желтоватый | Ва | После прокаливания наблюдается щелочная реакция |
| Зеленый | Бледно-желтоватый | Mo | После прокаливания щелочной реакци не наблюдается |
| Зеленый | Яркий, немного желтоватый | В | После прокаливания изредка наблюдается щелочная реакция. Вопрос о присутствии или отсутствии В решается пробой с куркумовой бумагой |
| Зеленый | Изумрудный | CuO CuCl |
При смачивании соляной кислотой пламя окрашивается в голубой цвет с зеленоватым оттенком |
| Зеленый | Бледно-голубоватый | Р | При смачивании концентрированной H2SO4 окраска часто становится виднее |
| Зеленый | Голубоватый | Zn | В наружной части пламени происходят вспышки |
| Голубой | Лазурный | CuCl2 | Наружные части пламени приобретают изумрудно-зеленый оттенок |
| Голубой | Лазурный | Se | Во время окрашивания пламени наблюдается характерный запах редьки |
| Голубой | Бледно-лазурный | Pb | Наружные части пламени приобретают зеленый оттенок |
| Фиолетовый | Бледный | К | Пламя через синее стекло кажется пурпурно-красным |
III. РЕАКЦИИ ОТДЕЛЬНЫХ ЭЛЕМЕНТОВ
Азот (N)
1. Вспышка на угле. Все азотнокислые соединения при нагревании на угле дают вспышку вследствие быстрого сгорания угля о г выделяющегося из нитратов кислорода.
2. Пары в закрытой трубке. При нагревании смеси нитратов с KHSO4 в закрытой трубке выделяются пары NO2, которые легко узнаются по запаху и красновато-бурому цвету.
Алюминий (Al)
Реакция с раствором Co(NO3)2. Небольшой кусочек или гонко измельченный порошок Аl-содержащего минерала прокаливается на угле, после охлаждения смачивается одной - двумя каплями раствора Co(NO3)2 и снова прокаливается; при остывании минерал приобретает светло-синий цвет (Тенарова синь). Необходимо, чтобы испытуемый минерал был неплавким. В противном случае синяя окраска будет обусловлена наличием не алюминия, а кобальта, окрашивающего оплавленные минералы.
Барий (Ва)
1- Окрашивание пламени. При сильном прокаливании в тонких осколках Ва-содержащие минералы окрашивают пламя в желто-зеленый цвет. Окрашивание пламени можно усилить, если после предварительного прокаливания смачивать минерал в крепкой соляной кислоте.
2 Осаждение сульфата бария. Из растворов Ва легко осаждается H2SO4. Выпадающий белый мелкокристаллический осадок BaSO4 трудно растворим в кислотах, что отличает Ва-соединения от борных и фосфорных, которые также окрашивают пламя в зеленый цвет.
Бериллий (Be)
1. Окрашивание Co(NO3)2. Прокаленный в окислительном пламени кусочек минерала, смоченный раствором Co(NO3)2 и вновь прокаленный, окрашивается в серовато-сиреневый цвет.
2. Осаждение углекислым аммонием. Силикаты бериллия предварительно сплавляют с содой и обрабатывают соляной кислотой. Из растворов бериллий осаждается углекислым аммонием; выпадает белый осадок, легко растворяющийся в избытке реактива (отличие от глинозема). При кипячении раствора снова выделяется осадок основной углекислой соли бериллия
3. Реакция с хинализарином. Осадок гидратов окислов бериллия, алюминия и железа, полученный после осаждения аммиаком, обрабатывают теплым раствором NaOH. К фильтрату прибавляют несколько капель щелочного раствора хинализарина. В присутствии следов бериллия фиолетовая окраска хинализарина переходит в васильково-синюю. Реакция очень чувствительная и характерная, алюминий не мешает.
Бор (В)
1. Окрашивание пламени. Пламя окрашивается в зеленый цвет, который легко спутать с цветом пламени Ва. Необходимо научиться их различать. Соединения бора испытывают следующими способами. Берут порошок минерала, смешивают с тремя объемами KHSO4 и одним объемом CaF2; в окислительном пламени получается ярко-зеленое окрашивание от выделения BF3. Если борнокислые соли смочить серной кислотой, прибавить немного метилового спирта и зажечь, то последний будет давать при горении зеленое пламя.
2. Окрашивание куркумовой бумажки. Куркумовая бумажка смачивается солянокислым раствором В-содержащего минерала и сушится над пробиркой с кипящей водой. Куркумовая бумажка окрашивается при этом в красновато-бурый цвет, при смачивании аммиаком — чернеет. Аналогичная окраска получается от циркониевой, титановой, танталовой, ниобиевой и молибденовой кислот; поэтому эта реакция производится на бор лишь в их отсутствии.
Бром (Вг)
1. Возгоны в закрытой трубке. Бромсодержащие соединения в смеси с сульфатом натрия при нагревании в закрытой трубке дают буровато красные пары брома.
2. Осаждение AgBr. Из водных и слабо азотнокислых бромистых растворов AgNO3 дает желтовато-белый осадок.
Ванадий (V)
1. Окрашивание перлов. Перл буры в окислительном пламени окрашивается в желто-зеленый цвет, в восстановительном — в чисто зеленый. Стекло фосфорной соли в окислительном пламени окрашивается в желтый цвет, в восстановительном — в чисто зеленый.
2. Окисление перекисью водорода. Прибавление нескольких капель перекиси водорода к кислым растворам ванадиевых соединений вызывает красновато-бурое окрашивание вследствие образования HVO4. Реакция очень чувствительна.
3. Восстановление цинком В кислой среде цинк вызывает восстановление ванадиевой кислоты; раствор изменяет окраску от голубого, через зеленый до фиолетового.
Висмут (Bi)
1. Королек и налет на угле. Смесь минерала с двойным объемом соды при нагревании в восстановительном пламени дает хрупкий металлический королек висмута и желтый налет Bi2O3. Or свинца королек висмута отличается отсутствием ковкости. Для большей убедительности рекомендуется проделать опыт с получением йодистого налета.
2. Получение налета на угле. Измельченный минерал со смесью S и KJ нагревают на угле в окислительном пламени получается налет желтого цвета близ пробы и ярко-красного — по краям (BiJ3).
Вольфрам (W)
1. Нерастворимый остаток в НСl. От вольфрамовых соединений при кипячении в пробирке с соляной кислотой выпадает желтый осадок WO3; при прибавлении нескольких крупинок зернистого олова или цинка и при дальнейшем кипячении цвет осадка переходит в синий (2WO, +WO2). После некоторого стояния осадок становится бурым (WO). Нерастворимые соединений необходимо предварительно сплавить с содой, а затем уже подвергать растворению в воде Некоторые вольфрамовые минералы при нагревании в НСl в присутствии зернистого олова или цинка дают синий осадок или сами окрашиваются в синий цвет (шеелит).
2. Окрашивание перла. Перл буры в окислительном пламени бесцветный, в восстановительном — желтый, до желто-бурого. Перл фосфорной соли в окислительном пламени также бесцветный, в восстановительном — голубой; после прибавления FeSO4 становится красным.
3. Реакция с алюминиевой пластин кой. Тонко истертый .порошок минерала смачивают водой на алюминиевой пластинке, после чего прибавляют небольшую каплю НСl. При стоянии раствор получает голубую окраску.
Железо (Fe)
1. Испытание на магнитность. Некоторые Fe-содержащие минералы обладают природными магнитными свойствами (магнетит, пирротин), другие же приобретают эти свойства лишь после прокаливания в восстановительном пламени. Для этой цели используется осколочек после пробы на плавкость. Кроме того, магнитность обнаруживают шлаки, получающиеся после сплавления Fe-содержащих минералов с содой.
2. Окрашивание перла Стекло буры в окислительном: пламени дает желтое, почти бесцветное окрашивание, в восстановительном — бледно-зеленое.
3. Осадок гидрата окиси. Из разбавленных кислых растворов, содержащих железо, от аммиака выпадает бурый осадок Fe(OH)3. Перед осаждением необходимо раствор прокипятить с несколькими каплями HNO3, чтобы перевести присутствующие, возможно, в растворе закисные соединения железа в окисные.
4. Реакции на соли закиси и окиси железа.
Нерастворимые в кислотах минералы сплавляют в
закрытой трубке с тремя объемами обезвоженной
буры. После сплавления трубку раскалывают, сплав
истирают в порошок и затем растворяют при
нагревании в воде с несколькими каплями H2SO4.
Раствор делится на две части: с одной
производится реакция на закисные соли железа, с
другой — на окисные.
а) При прибавлении красной кровяной соли K3Fe(CN)6
к холодному слабокислому раствору получается
темно-синий осадок - реакция на закись железа.
б) От прибавления нескольких капель NH4CNS или
KCNS получается тёмно-красное окрашивание
раствора—реакция на окисные соединения железа.
Золото (Au)
1. Получение королька. При наличии достаточного количества золота на угле с содой в восстановительном пламени получается металлический желтый королек, обладающий ковкостью и нерастворимый в кислотах.
2. Получение кассиева пурпура. Раствор в царской водке осторожно выпаривают досуха. Остаток растворяют в небольшом количестве воды. Капля хлористого олова (SnCl2) вызывает окрашивание раствора в пурпуровый цвет от выделившегося коллоидного золота. В случае значительного количества золота получается пурпуровый осадок.
Иод (J)
1. Возгоны в закрытой трубке. При нагревании смеси с KHSO4 возгоняется в виде фиолетовых паров; в смеси с порошком свинцового блеска (PbS) на стенках трубки получается возгон PbJ2 оранжево-красного цвета в горячем состоянии и желтого — в холодном.
2. Осадок AgNO3. Из разбавленного азотнокислого раствора от AgNO3 выпадает белый осадок AgJ, почти нерастворимый в аммиаке (отличие от AgCl и AgBr).
Кадмий (Cd)
Получение налета на угле. Смесь порошка минерала с тройным объемом соды при нагревании в окислительном пламени на угле дает красновато-бурый налет близ пробы, переходящий в желтый по краям.
Калий (К)
Окрашивание пламени. От солей калия пламя окашивается в фиолетовый цвет. Окраска пламени часто маскируется натрием, поэтому необходимо пользоваться синим стеклом, поглощающим желтый цвет.
Кальций (Са)
1. Окрашивание пламени. Са-содержащие минералы окрашивают пламя в кирпично-красный цвет; при смачивании HCl окраска становится более интенсивной. Если на пламя смотреть через зеленое стекло, то пламя представляется также зеленым.
2. Осаждение из растворов. Из растворов Са - соединений, содержащих небольшой избыток аммиака, Са легко осаждается щавелевокислым аммонием [(NH4)2 C2O4] или углекислым аммонием [(NH4)2CO3] в виде белого кристаллического осадка СаС2О4 или СаСО3. Щавелевокислый аммоний осаждает кальций также и из слабокислых растворов. Из солянокислых растворов Са осаждается H2SO4; достаточно нескольких капель последней, чтобы из раствора выпал белый осадок CaSO4 • 2Н2О, растворяющийся при кипячении в сильно разбавленном растворе (в отличие от BaSO4 и отчасти SrSO4, которые при этих условиях нерастворимы).
3. Щелочная реакция. Многие Са-содержащие минералы дают после прокаливания отчетливую щелочную реакцию на куркумовой бумажке.
Кобальт (Со)
Окрашивание перла. Перлы буры и фосфорной соли как в окислительном, так и в восстановительном пламени солями кобальта окрашиваются в интенсивный синий цвет. В присутствии меди и никеля к перлу добавляется маленькая крупинка зернистого олова, и перл нагревается в восстановительном пламени. В этом случае Cu и Ni восстановятся до металла и не будут мешать окраске, вызываемой кобальтом.
Кремний (Si)
1. Получение студенистой SiO2. Некоторые силикаты при разложении их кислотой (азотной или соляной) выделяют свободную кремневую кислоту, которая при выпаривании выпадет в виде студенистого осадка.
Опыт ведут следующим образом: в пробирку помещают немного тонко истертого минерала, например, оливина [(Mg,Fe)2SiO4] или нефелина (NaAlSiO4); порошок смачивают водой, затем прибавляют 3 см3 азотной или соляной кислоты и нагревают. Через некоторое время минерал переходит в раствор, и при дальнейшем кипячении выпадает студенистый осадок SiO2. При проведении этого опыта следует истирать минерал в тонкий порошок, иначе кислота будет действовать слишком медленно, так как крупинки будут обволакиваться нерастворимой студенистой SiO2 и дальнейшее растворение прекратится. В этом случае в растворе появятся лишь хлопьевидные образования SiO2. Вода, прибавляемая в начале опыта, также способствует лучшему смешению минерала с кислотой и предохраняет от вышеуказанного обволакивания SiO2.
2 Получение порошковатой SiO2. При растворении некоторых силикатов кремнезём может сразу выпадать в виде порошковатого нерастворимого осадка. В этом случае его очень трудно отличить от порошка неразложившегося минерала. Для проверки следует отфильтровать осадок и выпарить каплю прозрачного фильтрата на слюдяной пластинке или часовом стеклышке. Появление осадка при выпаривании покажет, что основания, находившиеся в силикате, действительно перешли в раствор.
3. Не разлагаемые кислотами силикаты предварительно сплавляются с тремя объемами соды: Na2CO3 i-SiO2 = Na2SiO3 + CO2. сплав растворяют в кислотах, в остальном — как указано выше.
4. Испытание с фосфорной солью. Кремнезем с трудом растворяется в стекле фосфорной соли. Кусочек или крупинка минерала, взятая для испытания с фосфорной солью, сохраняет свою форму, образуя так называемый скелет кремнезёма,, между тем как основания, находящиеся в силикате, переходят в раствор.
Литий (Li)
Окрашивание племени, Соли Li окрашивают пламя в карминово-красный цвет. Зеленое стекло не пропускает свет лития (в отличие от Са).
Магний (Mg)
1. Окрашивание раствором Co(NO3)2. Некоторые светлоокрашенные Mg-содержащие минералы, смоченные после прокаливания раствором Co(NO3)2 и снова сильно прокаленные, приобретают бледный мясо-красный цвет.
2. Осаждение из раствора. К солянокислому раствору Mg-содержащего минерала прибавляют несколько капель HNO3 кипятят; после охлаждения к раствору прибавляют небольшой избыток аммиака. Полученный осадок гидратов Fe и А1 отфильтровывают, к фильтрату прибавляют раствор щавелевокислого аммония для осаждения из раствора Са, снова отфильтровывают, к чистому фильтрату прибавляют раствор Na2HPO4—-получается белый кристаллический осадок.
Марганец (Mn)
1. Окрашивание перлов Стекла буры и фосфорной соли б окислительном пламени окрашиваются в красно-фиолетовый цвет, в восстановительном же становятся совершенно бесцветным. Для пробы на окрашивание следует брать очень маленькую садку, так как реакция весьма чувствительна.
2. Сплавление с содой и селитрой. Порошок минерала, сплавленный с содой на угле в окислительном пламени, окрашивает сплав в голубовато-зеленый (бирюзовый) цвет (Na2MnO4) в восстановительном пламени сплав белый. Реакция становится особо чувствительной от прибавления к соде небольшого количества KNO3.
3. Образование марганцевой кислоты. Минерал сплавляется с содой, затем обрабатывается слабым раствором HNO3; после прибавления нескольких капель AgNO3 к кипящему раствору постепенно добавляют порошок надсернокислого аммония [(NH4)2S2O7]. В зависимости от содержания Mn раствор от образования марганцевой кислоты приобретает цвет от розового до фиолетового. Весьма чувствительная реакция.
4. Реакция Фольгарда. Mn-содержащий минерал помещают в пробирку, прибавляют 3—4 смъ азотной кислоты и кипятят; к раствору прибавляют порошковатой перекиси свинца (РbО2) или сурика (РЬ3О4) и снова кипятят. По остывании, цвет раствора от образования марганцевой кислоты становится фиолетово-красным или розовым.
Медь (Cu)
1.Окрашивание пламени. Окислы меди дают изумрудно-зеленое окрашивание. Прокаленные Cu-содержащие соединения, смоченные НС1, окрашивают пламя в лазурно-голубой цвет CuС12). Реакция очень чувствительна.
2 Получение цветных перлов. Стекла буры и
фосфорной соли окрашиваются в окислительном
пламени в голубой цвет, в восстановительном же
при малой присадке становятся почти бесцветными,
а при большом количестве вещества—красными
непрозрачными.
Если к бледноголубому перлу прибавить очень
маленькое зернышко металлического олова или
какого-либо другого соединения олова и сплав
нагревать сначала в окислительном пламени, до
полного растворения, а затем медленно перенести
в восстановительное пламя, после чего быстро
удалить его из пламени, то перл получается
рубиново-красный прозрачный (эта же реакция
служит для обнаружения олова).
3. Получение металлического королька. Предварительно прокаленные соединения меди смешиваются с тройным объемом соды и подвергаются действию восстановительного пламени После длительного непрерывного дутья выплавляется красный королек металлической меди, обладающий большой ковкостью.
4. Цвет раствора. Азотнокислый и солянокислый растворы меди имеют голубой или зеленый цвет; при прибавлении аммиака цвет раствора изменяется в темносиний.
Молибден (Мо)
1. Налет на угле. После продолжительного прокаливания на угле в окислительном пламени паяльной трубки соединения Мо, не содержащие других примесей, образующих налеты, дают белый налет МоО3, который при быстром действии восстановительного конуса паяльной трубки окрашивается в бархатно-синий цвет, а при более медленном — в медно-красный.
2. Окрашивание пламени. При прокаливании MoS2 пламя паяльной трубки окрашивается в желтовато-зеленый цвет.
3. Получение перла с фосфорной солью. В окислительном пламени паяльной трубки получается бесцветный перл, в восстановительном — зеленый.
4. Получение молибденовой сини. Минерал сплавляют с содой, сплав переносят в маленький фарфоровый тигель, куда прибавляют немного концентрированной H2SO4, и выпаривают до появления белых паров SO3; при этом на стенках трубки появляется синяя кайма.
Мышьяк (As)
1. Налет на угле As-содержащие минералы при нагревании в окислительном пламени дают белый дым с резким чесночным запахом; на угле далеко от пробы образуется пепельно-серый налет As2O5.
2. Получение мышьякового зеркала в закрытой трубке Небольшие кусочки минерала или налет, полученный на угле и соскобленный вместе с углем, помещают в закрытую трубку. При нагревании в пламени паяльной трубки на стенке закрытой трубки образуется возгон металлического мышьяка черный, далеко от пробы „мышьяковое зеркало"— и светло-серый кристаллический — As2O3 — близ пробы.
3. Восстановление мышьяка цинком. Солянокислые растворы As-содержащих минералов при нагревании с металлическим цинком выделяют черную пену металлического мышьяка.
Натрий (Na)
1 Окрашивание пламени. Натрий окрашивает пламя в интенсивный желтый цвет. Силикаты натрия предварительно смешивают с равным объемом гипса и полученную смесь испытывают на платиновой проволоке.
2. Щелочная реакция. Некоторые соединения натрия после прокаливания дают ясную щелочную реакцию с куркумувой бумажкой.
Никель (Ni)
1. Окрашивание перла Стекло буры в окислительном пламени приобретает красновато-бурый цвет, в восстановительном оно становится серым, непрозрачным ввиду выделения металлического никеля. Наличие других элементов, Fe и Сu и особенно Со, очень маскирует реакцию на никель.
2. Реакция с диметилглиоксимом (реакция Чугаева). Тонко измельченный порошок минерала кипятят с соляной или азотной кислотой. После охлаждения в разбавленный раствор прибавляют небольшое количество какой-либо органической кислоты (винной или лимонной), избыток аммиака и несколько капель спиртового раствора диметилглиоксима; выпадает красивый малиново-красный осадок. Реакция очень чувствительна.
Ниобий (Nb)
Реакция с окрашиванием раствора. Тонкий порошок минерала сплавляется с 10-кратным объемом соды и растворяется в соляной кислоте до получения прозрачного раствора. затем к раствору прибавляют несколько крупинок зерненого олова и кипятят. При содержании в минерале Nb раствор окрашивается в голубой цвет. От продолжительного кипячения цвет раствора переходит в бурый, от прибавления же воды становится бесцветным
Олово (Sn)
1. Окрашивание перла буры с Cu — рубиново-красный перл с медью (см. медь). Очень чувствительная реакция.
2. Реакция на угле. Тонко истертый порошок минерала ;мешивается с равным объемом угля и двойным объемом соды; при действии восстановительного пламени на угле выплавляется белый ковкий металлический королек олова. В крепкой HNO3 олово не растворяется.
3. Реакция с металлическим цинком. Индивидуальная реакция на оловянный камень SnO2. Подозреваемый на SnO2 минерал предварительно испытывается на растворимость в кислотах. Если он не растворяется, то небольшое зерно его помещают в пробирку, куда прибавляют немного НСl (около 1 см3) и кусочек цинка, после чего нагревают. Зерно касситерита (SnO2) юкрываегся при этом слоем металла, особенно заметным после лгкой полировки о материю или бумагу. Еще лучше производить реакцию в капле НСl на цинковой пластинке.
Ртуть (Hg)
Возгон в закрытой трубке. Порошок минерала смешивают с четырьмя объемами обезвоженной соды и нагревают закрытой трубке; через некоторое время на стенках трубки появляются мелкие капельки металлической ртути. Для производства опыта необходимо брать сухую, обезвоженную соду, иначе выделяющаяся вода будет маскировать реакцию. При определении Hg в сернистых соединениях, например в киновари (HgS), лучше брать не соду, а железные опилки. Реакция в этом случае идет по уравнению HgS + Fe = FeS + Hg. Выделяющиеся при нагревании пары ртути амальгамируют медную фольгу; если лиcточек ее поместить в горлышко трубки, где производится опыт, Фольга белеет.
Свинец (Pb)
1. Получение королька Pb. Минерал истирают в порок и смешивают с равным объемом угля и тройным объемом соды, затем нагревают в восстановительном пламени на угле; лучившийся королек металлического свинца отличается большой ковкостью и легко режется ножом. Королек в восстановительном пламени — блестящий белый, после охлаждения он быстро становится матовым. При получении королька Pb образуется налет; зеленовато-желтого цвета близ пробы и белый по краям.
2. Получение налета на угле PbJ2. Порошок минерала смешивается с двойным объемом соды и смеси KJ+ S. При сплавлении и прокаливании на угле получается яркий зеленовато-желтый налет PbJ2; иногда близ пробы образуется красная кайма состоящая из окислов свинца.
Селен (Se)
.Цвет и окрашивание пламени. При действии окислительным пламенем на угле селенистые соединения издают характерный запах редьки, причем образуется серебристый налет с красными краями. При прикосновении конца конуса восстановительного пламени к налету селена пламя окрашивается в лазурно-синий цвет.
Сера (S)
1. Получение серной печени. Истертый в порошок минерал смешивается с тройным объемом соды и небольшим количеством угля, после чего сплавляется в окислительном пламени паяльной трубки на угле. Полученный шлак переносится на серебряную пластинку или монету, где смачивается каплей воды. При наличии серы в минерале на серебряной пластинке образуется черное или темнобурое пятно Ag2S. При проведении этого опыта нельзя пользоваться пламенем газа — необходимо реакцию сплавления с содой производить в пламени свечи или спиртовки.
2. Получение SO2. Реакция удается в случае сернистых соединений. Порошок минерала помещают в изгиб открытой трубки и прокаливают. SO2 определяют или по запаху или с мощью синей лакмусовой бумажки, помещенной в длинное колено открытой трубки, которая в парах SO2 краснеет. Селен и теллур дают подобную же реакцию, поэтому необходимо убедиться в их отсутствии.
3. Возгон S. Сернистые минералы при прокаливании в закрытой трубке дают желтый возгон серы.
Серебро (Ag)
1. Получение металлического королька Ag. Истертый порошок или мелкие кусочки минерала, если минерал ковкий и не истирается в порошок, смешиваются с тройным объемом соды и подвергаются действию восстановительного пламени на угле. Получается ковкий серебряно-белый королек, который остается блестящим и после охлаждения.
2. Осаждение хлористого серебра. Полученный королек или Ag-содержащий минерал растворяют в крепкой азотной кислоте; раствор разбавляют водой и прибавляют несколько капель соляной кислоты, после чего выпадает белый творожистый осадок AgCl, легко растворяющийся в аммиаке.
Стронций (Sr)
1. Окрашивание пламени. Соли стронция окрашивают пламя в яркий карминово-красный цвет, очень схожий с цветом пламени лития, но отличающийся от последнего более красным оттенком и большей стойкостью.
2. Щелочная реакция. Соединения стронция после прокаливания дают ясную щелочную реакцию на куркумовой бумажке.
Сурьма (Sb)
1. Налет на угле. В окислительном пламени сурьмянистые минералы дают на угле густой плотный белый налет Sb2O3. В отличие от мышьяка, налет ложится близко от пробы и в смеси с углем не дает зеркала в закрытой трубке. При получении налета не ощущается чесночного запаха.
2. Возгон в открытой трубке. В открытой трубке получается густой белый возгон SbSbO4 недалеко от пробы.
Теллур (Те)
1. Налет на угле. При нагревании в окислительном пламени выделяется дым и появляется белый налет ТеО2 на угле близко от пробы, как у сурьмы. Теллур в этом случае можно отличить от сурьмы по окрашиванию восстановительного пламени. Восстановительное пламя от теллура окрашивается в зеленый цвет, а от сурьмы—в зеленовато-голубой.
2. Окрашивание раствора Н2SО4. Концентрированную серную кислоту кипятят для удаления излишней воды, затем прибавляют порошок исследуемого Те-содержащего минерала и осторожно нагревают (не до кипения); появляется карминово-красное окрашивание раствора, исчезающее при кипячении или при разбавлении водой.
Титан (Ti)
1. Восстановление раствора Ti оловом. Мелко измельченный минерал сплавляется с содой, после чего растворяется в соляной кислоте. Полученный раствор TiCl4 кипятят с небольшим количеством зерненого олова; при восстановлении образуется TiCl3, который придает раствору фиолетовый цвет. Эта реакция ясно получается лишь при значительном содержании Ti в минерале, при малых количествах титана в минерале лучше делать реакцию с перекисью водорода.
2. Реакция с перекисью водорода. Минерал, сплавленный с содой, растворяется в разбавленной H2SO4; раствор нагревают, дают остыть, затем прибавляют несколько капель перекиси водорода (Н2О2). В зависимости от содержания титана раствор окрашивается в цвета от желтого до оранжевого. Реакция чрезвычайно чувствительна.
3. Окрашивание перла. Перл фосфорной соли в окислительном пламени становится бесцветным, в восстановительном — фиолетовым. Реакция с окрашиванием перла получается яснее при присадке крупинки олова.
Углерод (С)
A. Органические вещества (углероды, битуминозные угли и пр.) при нагревании в закрытой трубке разлагаются с выделением горючих газов, паров воды, NH3 части масел и смолистых веществ, сгущающихся в трубке, причем наблюдается характерный пригорелый запах, а в остатке получается чистый углерод. Антрацит в закрытой трубке дает немного воды, а в окислительном пламени паяльной трубки сгорает.
B. Углекислые соединения при растворении их в кислотах разлагаются с выделением углекислого газа, сопровождающимся характерным шипением. Некоторые минералы шипят на холоду, другие же требуют нагревания. Такие минералы, как кальцит и арагонит, ведут себя по отношению к кислотам одинаково; для их определения используют дополнительную реакцию с раствором Co(NOg)2 (реакция Мейгена). Тонко истертый nopoшок неизвестного минерала и кальцита помещают в отдельные пробирки, наполняют последние раствором Co(NO3)2 и кипятят. Порошок арагонита приобретает сиреневую окраску, кальцит же остается белым и лишь после длительного кипячения приобретает такую же окраску.
Уран (U)
Окрашивание перла. Стекло фосфорной соли в окислительном пламени окрашивается в желто-зеленый цвет, в восстановительном — в чисто-зеленый.
Фосфор (Р)
1. Осаждение из раствора молибденовокислым аммонием. Фосфорсодержащие минералы растворяют в HNO3 (если это труднорастворимый минерал, то его предварительно сплавляют с содой); полученный раствор приливают к нагретому раствору молибденовокислого аммония в другой пробирке. После непродолжительного стояния выпадает желтый осадок (NH4).PO4 • 12МоО3.
2. Реакция с металлическим магнием. Испытуемый
минерал прокаливают, измельчают и смешивают с
тройным объемом порошка металлического магния.
Смесь помещают в закрытую трубку и нагревают в
пламени паяльной трубки; происходит
восстановление фосфорнокислых соединений до
фосфида магния (Mg3P2).
Реакция идет со вспышкой, а при большом избытке
порошка магния — даже с легким взрывом; поэтому
при производстве опыта надо соблюдать
осторожность и стеклянную трубку направлять от
себя в сторону. После охлаждения спекшуюся массу
смачивают через горлышко трубки каплей воды; при
этом выделяется РН3, издающий неприятный
запах гнилой редьки:
3 Окрашивание пламени. Фосфорнокислые минералы, смоченные серной кислотой, окрашивают пламя паяльной трубки в голубовато-зеленый цвет.
Фтор (F)
1. Травление стекла. Реакция удается со всеми соединениями фтора, кроме силикатов. Фторсодержащий минерал истирают в порошок, переносят на свинцовую пластинку, где смачивают серной кислотой; затем смесь нагревают и переносят на предметное стекло, покрытое предварительно слоем воска, стеарина или парафина, на котором проводят несколько черточек до самого стекла. На это место помещают нагретую каплю смеси и переворачивают стекло так, чтобы капля висела книзу. В таком положении пробу оставляют на 10—15 минут, затем счищают воск. При наличии F стекло, не покрытое воском, протравится. При действии серной кислоты освобождается фтористый водород, который реагирует со стеклом, не защищенным слоем воска, выделяя при этом фтористый кремний и воду.
4HF + SiO2 =s= SiF4 +2Н2О
2. Сплавление с KHSO4. Порошок минерала смешивают с равным объемом истертого стекла и тремя объемами KHSO4. Смесь помещают в закрытую трубку и осторожно нагревают; на холодных стенках трубки образуется белый налет.
Хлор (С1)
1. Окрашивание пламени. Истертый минерал смешивают с порошком окиси меди; смесь смачивают серной кислотой, осторожно высушивают на угле, пользуясь легким дутьем паяльной трубки, и затем накаливают. Появление лазурно-голубого окрашивания пламени от образовавшегося летучего соединения CuС12 указывает на наличие хлора в исследуемом минерале. Такой же результат получается, если нагревать в окислительном пламени стекло фосфорной соли, насыщенное окисью меди, и зернышко хлорсодержащего минерала.
2. Выделение хлора. Порошок хлористого минерала вместе с небольшим количеством пиролюзита (MnО2) и четырьмя частями KHSO4 помещается в открытую трубку и нагревается. Выделение хлора узнается по белящему действию на смоченную лакмусовую бумажку, помещенную внутри длинного колена трубки.
3. Осаждение хлористого серебра. В водных или азотнокислых растворах хлористых соединений несколько капель раствора AgNO3 дают белый осадок (если хлора много — творожистый, если мало — голубоватый, опалесцирующий); сходные реакции дают иод и бром.
Нерастворимые минералы предварительно сплавляются с тремя объемами соды.
4. Возгон с PbS. Чтобы установить различие хлористых, бромистых и йодистых соединений, проводят реакцию с порошком свинцового блеска. Для этого исследуемый минерал смешивают с порошком свинцового блеска (PbS) и помещают в закрытую трубку; при нагревании на стенках трубки получаются возгоны:
Хром (Cr)
1. Окрашивание перлов. Стекла буры и фосфорной соли в окислительном пламени окрашиваются в желтовато-зеленый цвет, в восстановительном—в изумрудно-зеленый.
2. Сплавление с содой. Смесь минерала с содой сплавляется на угле; в окислительном пламени получается непрозрачный сплав желтого цвета:
Сг2О3 + 2Na2CO3 = 2Na2CrO4 + 2CO2, в восстановительном—желтовато-зеленый.
Чувствительность реакции увеличивается от прибавления к сплаву KNO3.
Цинк (Zn)
Получение Ринмановой зелени. Измельченный минерал смешивают с двумя объемами соды и нагревают на угле в восстановительном пламени—близ пробы получается белый налет ZnO; после охлаждения налет смачивают одной - двумя каплями азотнокислого кобальта и снова нагревают в окислительном пламени. При наличии Zn налет окрашивается в зеленый цвет :(Zn,Co)O.
Цирконий (Zr);
Реакция с куркумовой бумажкой. Порошок минерала сплавляют с содой и растворяют в небольшом количестве соляной кислоты. От смачивания этим раствором желтая куркумовая бумажка становится оранжево-красной. Цвет куркумовой бумажки, полученный от смачивания в растворе Zr-соединения, сравнивают с цветом бумажки, погруженной в соляную кислоту.